Avião que transportava vacinas entra em rota de colisão com jato da GOL no Paraná
Na manhã da última terça-feira (19), um avião monomotor carregado com vacinas entrou em rota de colisão com uma jato da companhia GOL ao realizar uma curva errada momentos após a decolagem, que fez com que a aeronave entrasse na rota da companhia aérea. As informações são do portal Aeroin site de notícias de aviação comercial. O jato da GOL era um Boeing 737-800 da GOL de matrícula PR-GUC, que quase foi atingido pelo Cessna C208 Caravan do governo do Paraná, de matrícula PP-MMS. O monomotor decolou do Aeroporto Bacacheri, no centro de Curitiba, com doses da Coronavac em direção a Londrina.
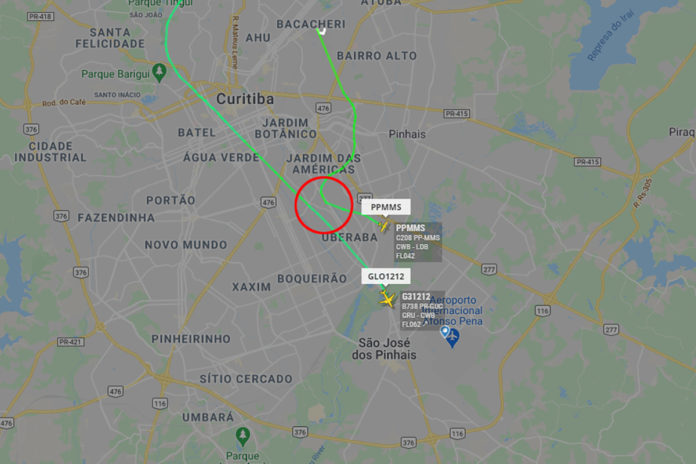
Imagem: Trajetória das duas aeronaves – Reprodução/FlightRadar24
Em nota, nesta quarta-feira (20), o Governo do Paraná informou que o piloto automático, devidamente acoplado, apresentou uma atitude inesperada, curvando à direita, mas que a situação foi corrigida rapidamente.
“Ressaltamos que não houve um acidente, mas um incidente, o qual foi devidamente reportado às autoridades aeronáuticas”, diz um trecho da nota. O órgão garantiu que uma investigação foi aberta para apurar o ocorrido.
Confira a nota do governo estadual na íntegra:
Em atenção ao incidente havido no dia de hoje (19/01/2021), envolvendo aeronave Grand-Caravan, prefixo PP-MMS, do Estado do Paraná, e de aviação comercial, no terminal do aeroporto Afonso Pena, em Curitiba/PR, a Casa Militar da Governadoria tem o seguinte a informar: Segundo relato do comandante da aeronave prefixo PP-MMS, após todos os procedimentos técnicos de decolagem, o piloto automático, devidamente acoplado, apresentou uma atitude inesperada, curvando à direita.
Diante disso, a tripulação tomou os procedimentos técnicos necessários, porém este não respondeu de imediato, e que logo após foi obtida a informação de tráfego. Nesse momento, foi desacoplado o piloto automático e retomado o procedimento de decolagem sem o auxílio do equipamento. Ressaltamos que não houve um acidente, mas um incidente, o qual foi devidamente reportado às autoridades aeronáuticas.
Dentro da dinâmica da aviação, foram tomadas as medidas técnicas mitigadoras para manter a segurança de voo. Isso significa que a tripulação estava atenta e segura em seus procedimentos. Após a Casa Militar tomar conhecimento do fato, determinou que a aeronave permanecesse em solo, até a intervenção de manutenção. Nesse tocante, destacamos que todas as aeronaves sob responsabilidade do órgão estão com suas manutenções em dia. Em relação ao incidente, sem prejuízo da apuração aeronáutica, a Casa Militar irá realizar uma averiguação interna do ocorrido.
A GOL também se manifestou em nota oficial e garantiu que não houve qualquer anormalidade no voo:
“A aeronave GOL que realizou o voo G3-1212 (Guarulhos-Curitiba), na terça-feira (19/1), teve de fazer um novo procedimento de pouso durante a aproximação ao aeroporto Afonso Pena. A mudança foi necessária por solicitação do controle de tráfego aéreo do destino para procedimento de segurança, sem qualquer anormalidade no voo. Reforçamos que a Companhia está sempre atenta à Segurança, nosso valor número 1″.
Foto: Divulgação/Governo do Paraná